Substitution nucléophile aromatique
La substitution nucléophile aromatique est un outil extrêmement utile pour la fonctionnalisation des composés d’aryle. Cette méthode existe depuis les années 1950 et reste très courante dans le domaine de la synthèse organique, même si des méthodes plus modernes de couplage de l’azote et du carbone aromatique, comme le couplage croisé de Buchwald-Hartwig, gagnent en popularité depuis quelques dizaines d’années.
Comme pour toutes les réactions de substitution, un nucléophile, comme une amine ou un alcool, déplace un groupe partant sur le cercle aromatique, en général un halogénure.
Il existe différents mécanismes associés à la substitution nucléophile aromatique. Seulement trois d’entre eux ont un intérêt pratique pour la synthèse organique :
- Mécanisme d’addition/élimination
- Mécanisme de benzyne
- SN1 aromatique de sels de diazonium
La substitution SNAr par mécanisme d’addition/élimination est la réaction la plus courante. Elle est la plus utilisée pour les substitutions d’halogénures d’aryle. L’effet électroattracteur du substituant facilite l’addition du nucléophile sur le cercle en stabilisant les intermédiaires à charge négative avant l’élimination du groupe partant.

Le mécanisme de benzyne est utile pour les halogénures d’aryle sans substitution et s’effectue avec un intermédiaire de benzyne, comme sur le schéma ci-après.

Enfin, la SN1 aromatique se produit dans le cadre de sels de diazonium aromatiques avec la formation d’un intermédiaire cation d’aryle via l’élimination de N2 et l’addition consécutive du nucléophile pour obtenir le produit de substitution.
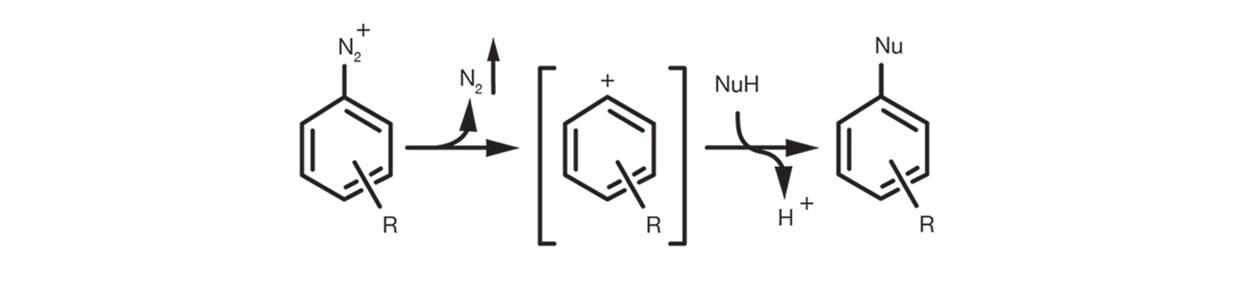
La préparation de la réaction est relativement simple. Elle est généralement réalisée dans des solvants organiques relativement polaires, protiques et aprotiques, comme le DMSO, l’éthanol, le DMF et le NMP. Elle est prise par l’utilisation d’une base auxiliaire (les amines tertiaires et les carbonates sont les bases les plus courantes) et nécessite rarement des excédents de nucléophile.
Protocoles de réaction de référence
1.
Peser des quantités équimolaires d’halogénure d’aryle et d’amine (5 à 50 mmol). Ajouter 1,5 à 2 équivalents de carbonate de potassium (ou une base alternative) dans de l’éthanol. Chauffer pour un reflux pendant 8 à 24 h.
Les dérivés d’aniline peuvent généralement être précipités facilement par un changement de pH.
2.
Peser des quantités équimolaires d’halogénure d’aryle et d’alcool, dissoudre dans du THF et suspendre 1,5 équivalent d’hydrure de sodium. Agiter pendant 8 à 24 h. La réaction peut se poursuivre à température ambiante, mais il est souvent nécessaire de chauffer jusqu’à 80 à 100°C.
Les produits de l’éther sont généralement séparés par extraction avec de l’eau et des solvants polaires ou apolaires. Le sulfate de magnésium est fréquemment utilisé pour retirer l’eau, tandis que le vide est adapté pour retirer les composés volatils.
Les thiols peuvent être utilisés comme des nucléophiles, et le protocole de réaction est normalement le même que pour les alcools.
3.
Dissoudre l’halogénure d’aryle, un léger excédent de cyanure de potassium (1,1 à 1,3 équivalent) et une quantité équimolaire de triméthylamine dans du DMSO. Agiter la réaction à environ 50°C pendant 12 à 24 h en ajoutant de l’eau au goutte-à-goutte.
Les produits de la réaction peuvent être dilués dans de l’eau et extraits à l’acétate d’éthyle ou avec d’autres solvants polaires aprotiques.
Une purification chromatographique est souvent nécessaire.
Exemples
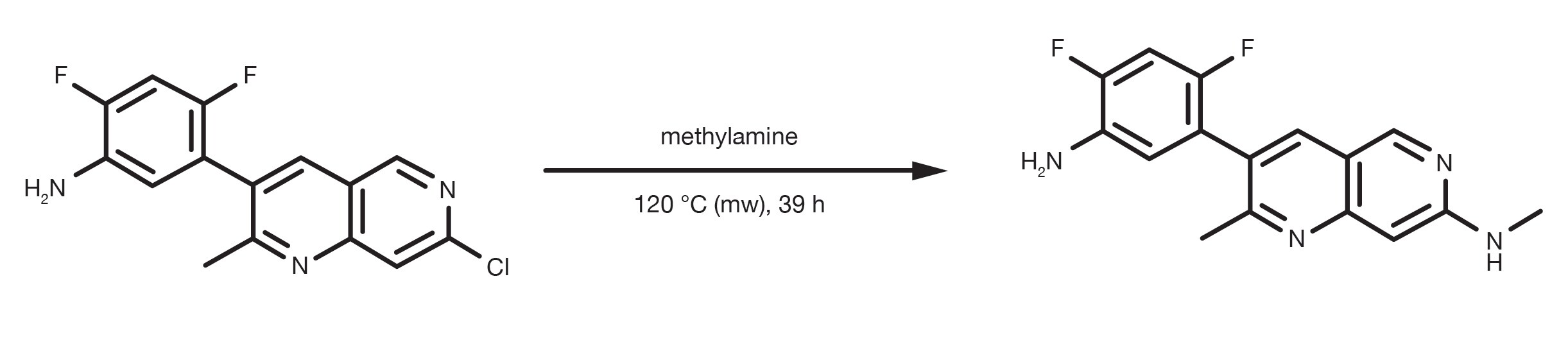
Référence de brevet : WO2013134298

Référence de brevet : WO2014149164
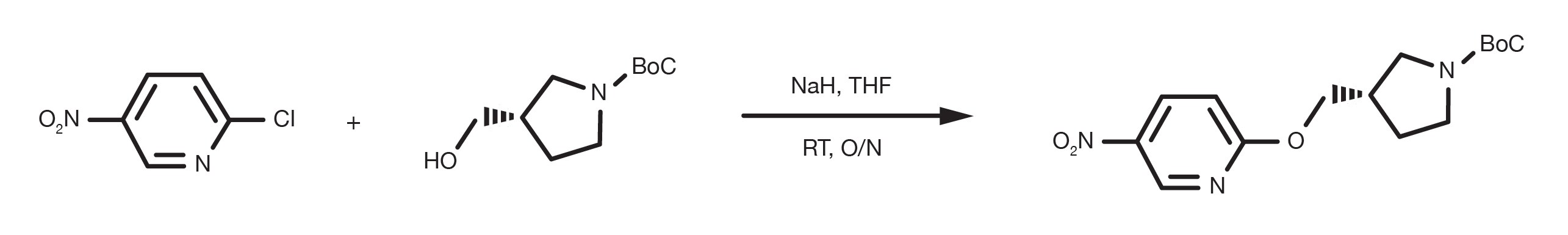
Référence de brevet : WO2016012477
Publications de référence clés
- Chem. Rev., 1951, 49 (2): 273–412. https://doi.org/10.1021/cr60153a002
- Molecules 2006, 11, 130-133. https://doi.org/10.3390/11020130
Choix de produits
Solvants :
Ingrédients/additifs basiques :
Bases :
Solution de méthoxyde de sodium
Tert-butoxyde de potassium solide
Solution de tert-butoxyde de potassium
1,4-diazabicyclo[2.2.2]octane (DABCO)
Catalyseurs :
Le gel de silice peut être utilisé comme un catalyseur dans certaines réactions à haute température du chlorobenzène sans substitution
Blocs de construction :
Halogénures d’aryle (poly)substitués :
Halogénures n-hétéroaryles :
Chlorhydrate de 4-chloropyridine
Autres halogénures de pyridinyle
Sels de diazonium (hétéro)aryles :
Tétrafluoroborate de 4-nitrobenzènediazonium
Tétrafluoroborate de 4-méthoxybenzènediazonium
Tétrafluoroborate de 4-bromobenzènediazonium
Nucléophiles :
amines (primaires, secondaires et tertiaires)
Autres amines aromatiques primaires
Autres amines d’alkyle primaires
Amines secondaires aromatiques
Alcools aliphatiques primaires
Alcools aliphatiques secondaires
Alcools aromatiques (différents phénols substitués) :
Thiols :
Autres nucléophiles :
